Wissenschaftler enthüllen Chemotherapie-Resistenz-Mechanismus bezüglich p53 mutation
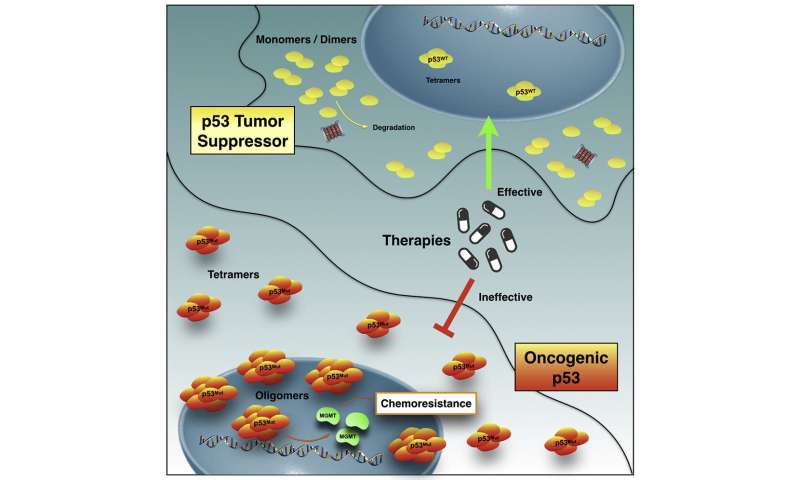
Mehr als die Hälfte der Krebs-Erkrankungen weltweit sind im Zusammenhang mit genetischen Mutationen in p53, das protein verantwortlich für das schützen von DNS vor Veränderungen, die zu Krebs führen kann. Wenn dieses protein verformt, verliert nicht nur seine Schutzwirkung, kann aber auch gewinnen Sie neue Funktionen, fungieren als „Verräter“ und ein Beitrag, um die Ausbreitung des Tumors durch Bildung von protein-Clustern, die möglicherweise resistent gegen Chemotherapie. Die Mechanismen, durch die diese Auftritt, und wie Sie es bewirkt, dass Resistenzen sind noch nicht vollständig verstanden.
Eine Gruppe Brasilianischer Forscher um den Biochemiker Jerson Lima Silva, professor an der Federal University of Rio de Janeiro (UFRJ), nicht ABGEDECKTE Teil des Geheimnisses. In einer neuen Studie identifizierten die Forscher das Vorhandensein einer großen Menge des proteins Verräter-version in Chemotherapie-resistenten Zellen aus dem Glioblastom, ein super aggressiven Gehirntumor. Sie fanden auch, wie die deformierten Proteine sind organisiert innerhalb der Zelle ausüben Widerstand: Sie bilden Klumpen, die größer als die in gesunden Personen, einige mit amyloid-Eigenschaften, das heißt, wenn die mutation führt zu Klumpen. Diese Strukturen wurden beobachtet, im Kern von lebenden Zellen für die erste Zeit. Die Ergebnisse sind veröffentlicht in iScience.
Die Verwendung von lebenden Zellen wichtige Beiträge zur Forschung auf dem Gebiet. „Im Gegensatz zu anderen Studien, die wir identifiziert kleine oligomere (Strukturen, die ein wenig größer als die gesunde version von p53) in lebenden Zellen, einen Beitrag zur Identifizierung von p53-Aggregate näher zu dem, was kommen sollte, die im menschlichen Organismus. Dies war nur möglich, weil die Zusammenarbeit mit dem Forscher Enrico Gratton, wer entwickelt die Fluoreszenz-Fluktuation-Spektroskopie-Analyse“, erklärt Murilo Pedrote, ein student am National Institute of Science and Technology for Structural Biology and Bioimaging (INBEB) und ersten Autor von der Studie.
Die Forschung wurde durchgeführt mit einer p53-spezifischen mutation (M237I). „Dies ist wichtig, weil das native protein (ohne mutation) und andere Mutationen sind nicht in der Lage, die übertragung der gleichen Droge-Widerstand“, sagt Guilherme A. P. de Oliveira, professor an der UFRJ und eine der Studie Koordinatoren.
Lima Silva hat die Gruppe studiert p53-Mutationen seit über 15 Jahren. Sein Labor war der erste, erkennen die Neigung des deformierten protein zu bilden amyloid-Aggregate und Ihre wichtige Rolle in der Krebsentstehung durch Verlust der Funktion, negative Dominanz (wenn auch mutierte Versionen des proteins binden an die gesunden, die änderung Ihres Verhaltens) und Verstärkung der Funktion. Nachdem die Wissenschaftler beobachtet, dass mutiertes p53-amyloid-Aggregate sind in Brust -, Eierstock-und Prostatakrebs. Aufgrund Ihrer Merkmale, diese amyloid-Cluster haben sich zu einem neuen Ziel für Anti-Krebs-Therapie.



