Wie die historisch missverstanden amyloid hilft zum speichern von Erinnerungen
Zum ersten mal haben Wissenschaftler aus der Stowers Institut für Medizinische Forschung und der Mitarbeiter beschrieben haben, die Struktur einer endogen verfügbaren, funktionierenden neuronalen amyloid-mit atomarer Auflösung. Amyloid besteht aus selbst-aggregierten Orb2, die Fruchtfliege version des mRNA-bindenden zytoplasmatischen polyadenylation element-binding (CPEB) protein, das im Zusammenhang mit der langfristigen Speicher. Die Ergebnisse dieser Arbeit, online veröffentlicht März 13, 2020, in der Wissenschaft, haben einige sehr interessante Implikationen.
„Wir dachten, dem üblichen Weg amyloids entstehen, wenn ein protein, dass aus irgendeinem Grund schlecht geworden oder fehlgefaltete, Hinweise amyloid-Bildung in einem stochastischen, nicht-Prozess“, erklärt Kausik Si, Ph. D., Stowers investigator und associate scientific director. „Wir fanden stattdessen, dass amyloids können form und einer ganz bestimmten Zeit, in einer ganz bestimmten Zelle in einer ganz bestimmten Art und Weise.“
Amyloids sind in der Regel verstanden, die im Rahmen der assoziierten neurotoxischen oder degenerative Zustände. Im Fall von Alzheimer, Parkinson, Huntington und Creutzfeld-Jakob-Krankheiten, Proteine aggregieren in einer absurden Weise zu bilden stabile, unlösliche Ablagerungen, die sich verheerend in das Nervensystem.
Jedoch, in 2003, Si und seinem mentor an der Zeit, Eric Kandel, MD, entdeckte die Existenz eines amyloid mit adaptiven Funktionen des Nervensystems während des Studiums CPEB im Meer, nacktschnecke Aplysia californica. Durch nachfolgende Studien in den Mäusen und der Taufliege Drosophila melanogaster, Si und andere zeigten, dass in der Tat, die einzigartigen Eigenschaften von CPEB und Orb2 protein self-Aggregate (amyloids), waren wichtig, um deren ordnungsgemäße Funktion an den Synapsen.
Diese Studien haben gezeigt, dass CPEB/Orb2 ist in verschiedenen funktionellen und strukturellen Zustände im Gehirn. Die primäre form ist ein monomer, das unterdrückt die translation an Synapsen, aber wie das Gedächtnis gebildet wird, werden diese Monomere selbst-zusammenbauen in biochemisch aktiven Aggregate, die Förderung der synaptischen übersetzung. Dieser übergang ist notwendig für Speicher-Persistenz.
„Sie postuliert, dass die amyloid-Staat war wahrscheinlich wichtig, aber bis zu diesem aktuellen Arbeit, es war nicht bewiesen endgültig, dass der körperliche Zustand des proteins ist ein amyloid“, erklärt Ruben Hervas, Ph. D., Erster Autor des Papiers und ein senior research associate in der Si-Labor.
Hervas studierte krankmachenden amyloids während der graduate school. „Ich wollte für meine biophysikalische hintergrund zur Untersuchung der strukturellen Eigenschaften von anderen amyloid-bildenden Proteinen—die guten“, sagt er.
Nach Hervas trat der lab im Jahr 2016, er und Si vereinbart früh, dass der beste Weg zur Untersuchung der Struktur von Orb2 zu nutzen, um protein aus einer endogenen Quelle (viele Fruchtfliegen), eher als rekombinante Orb2 die extrahierte Bakterien—obwohl es wäre viel schwieriger.
Rekombinante Orb2, im Gegensatz zu endogenen Orb2, ist nicht biochemisch aktiv ist, erklärt Hervas. „Die ursprüngliche Umgebung, das Nervensystem, wichtig für die Erhaltung der aktiven Konformation des proteins, sowie seine interessantesten Eigenschaften—in Bezug auf seine Fähigkeit zur selbst-aggregieren und bilden eine biochemisch aktive amyloid-Struktur im Zusammenhang mit dem Gedächtnis.“
Hervas und das team vor eine weitere Hürde. „Da das protein ist so groß, etwa 700 Aminosäuren, es ist nicht leicht zu kristallisieren. Zum Beispiel, amyloid-Strukturen gelöst, die von X-ray crystallography bisher nur die Peptide aus wenigen Aminosäuren.“ So, Hervas Fort, „Kryo-Elektronenmikroskopie (EM) die Möglichkeit angeboten, zu lösen diese Art von Struktur.“
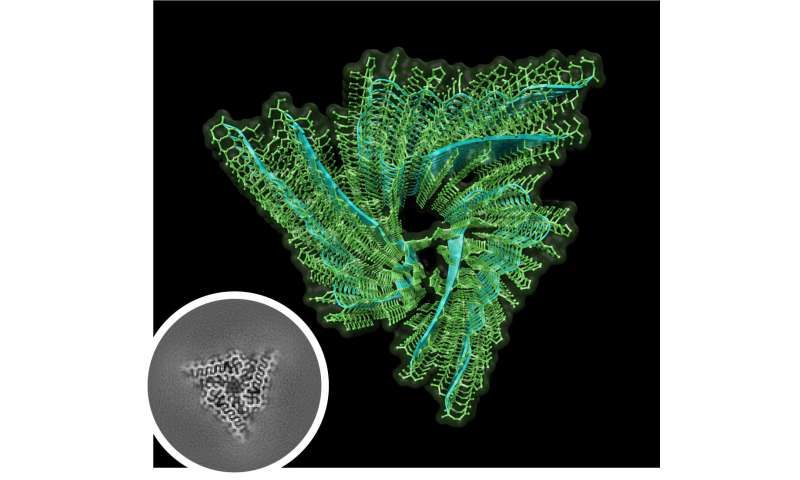
In der aktuellen Arbeit, Hervas und Kollegen gereinigt Orb2 von rund drei Millionen Erwachsenen Drosophila – Köpfen. In diesen Proben Orb2 gab es, wie Monomere, oligomere oder selbst-aggregierte Filamente (amyloids). Die Forscher zunächst bestätigt, dass das Orb2-Filamente waren in der Lage, seeding weitere filament-Bildung, und dass das gereinigte Orb2 Formen wurden biochemisch aktiv ist, in der Lage, die Unterdrückung der protein-übersetzung, die in den Monomeren Zustand und in der Lage, die Aktivierung der protein-translation-oligomere und-filament-Staaten.
Ihrer herkulischen Anstrengungen haben sich gelohnt. Mithilfe der Kryo-EM-Proben von über 97% Reinheit, Hervas und Kollegen waren in der Lage zu lösen, die Struktur der endogenen Drosophila Orb2 2,6-ångström-Auflösung. Sie fanden, dass endogene Orb2 gebildet dreifach-symmetrischer amyloid-Filamenten, waren etwa 75 Nanometer lang. Sie bestätigt, dass Orb2-Aggregate, die in der cross-beta-amyloid-Strukturen und entdeckt, dass die Haarnadel-wie Falten seiner protofilament-Kerne, bestehend aus 31 Aminosäuren, pack über hydrophile Schnittstellen.
Diese Arbeit lieferte auch eine partielle Antwort auf eine sehr wichtige Frage—wie ist es möglich, dass amyloids eines neuronalen proteins helfen, Speicher Speicher, wenn amyloids im Allgemeinen sind im Zusammenhang mit dem Verlust des Gedächtnisses? In Ihrem Papier, schlussfolgerten die Autoren, dass im Gegensatz zu den hydrophoben Kern der pathogenen amyloids, die hydrophilen Kern von Orb2 Filamente deutet, wie einige neuronale amyloids werden konnte, eine stabile und gleichzeitig regelbar Substrat des Gedächtnisses.
„Dieser Befund ändert die Art, wie wir denken, Proteine, Faltung und Montage“, sagt Si. „Die Art, wie wir denken über die Biologie ist jetzt: Sie haben ein gen, machen Sie eine Zeichenkette von Aminosäuren, und einmal ein Polypeptid gebildet wird, ist darauf programmiert, in einer Konformation, weil es eine bestimmte Funktion verknüpft. Wenn es von dem abweicht, – Pfad, ein system ist da, um es zu entfernen. Aber diese Arbeit schlägt vor, dass manchmal eine Zelle ermöglicht es, die gleiche protein zu bilden eine völlig andere Konformation. Wie tut es es? Wann tut er das?“
Die konformationsänderungen Flexibilität der einige Proteine, die die Möglichkeit eröffnet, dass ein protein kann mehr als eine Funktion, abhängig von konformationsänderungen Zustand—ein Phänomen, das Si und seine Mitarbeiter werden daran interessiert zu studieren, vorwärts.
Während Speicher-assays in Drosophila sind informativ, Hervas und Kollegen sind weiter auf der Suche nach vorne, um zu bestimmen, ob solche funktionellen amyloids gibt es auch im Nervensystem von Mäusen und Menschen, vor allem, weil das Nervensystem des Menschen ist besonders anfällig für amyloid-basierte Krankheiten. Es gibt vier CPEB-Isoformen, die jeweils mit mehreren Varianten, bei Mäusen und Menschen, erklärt Hervas. „Einige spezifische Isoformen in Mäusen sind auch wichtig für die gedächtniskonsolidierung, und diese sind fast identisch in der protein-Sequenz zum entsprechenden humanen Isoformen.“
„Wir starten mit CPEB-Proteine, extrahiert aus der menschlichen medialen Temporallappens, ein Struktur, wo bleibende Erinnerungen befinden. Wir lösen wollen, die Struktur, und dann möglicherweise die Verbindung zwischen den Speicher-und protein-Struktur mit der Maus-Modelle.“
„Das Gehirn ist eines der Systeme, das sich weiterentwickelt und diversifiziert, die meisten Organismen immer komplexer wurde,“ Si widerspiegelt. „Aber wenn man sich die Anzahl von Proteinen beteiligt, die eigentlich nicht dramatisch ändern. Eine Möglichkeit ist, dass komplexere biologische Systeme verwenden diese konformationsänderungen Raum zu schaffen, mehr Funktionen. Anstelle der Schaffung neuer Proteine, nur in einer anderen Form schaffen könnte, neue Funktion.“
Andere Mitautoren dieser Arbeit sind Younshim Park vom Stowers Institute; Michael J. Rau und James A. J. Fitzpatrick, Ph. D., von der Washington University in St. Louis; und Wenjuan Zhang, Ph. D., Alexey G. Murzin, Ph. D., und Sjors H. W. Scheres, Ph. D., vom MRC-Labor der Molekularbiologie.
Diese Arbeit wurde finanziert im Teil von der Stowers Institut für Medizinische Forschung und von der britischen Medical Research Council (award MC_UP_A025_1013, S. H. W. S.).
Legen Zusammenfassung der Ergebnisse
Proteine sind im Allgemeinen gedacht zu erlassen, um eine einzelne Form, oder „Falten“, und die Form eines proteins bestimmt seine Funktion. Jedoch werden einige Proteine annehmen können, um eine sekundäre Form, die sogenannte „amyloid“, wie Sie selbst zusammensetzen. Historisch, amyloids gedacht haben als nicht-funktionale und sogar Krankheit verursacht, besonders im Gehirn, wie im Fall der Alzheimer-Krankheit.
Überraschend ist jedoch, die Arbeit von Kausik Si, Ph. D., von der Stowers Institut für Medizinische Forschung, und andere, hat gezeigt, dass ein protein, das für die langfristige Gedächtnisbildung und-Persistenz, genannt Orb2, können in der Lage sein zu verabschieden, die die Form eines amyloid als Teil des normalen und notwendigen Funktion. Allerdings hatte er nicht nachgewiesen, dass Orb2 existiert im Gehirn als ein bona-fide-amyloid, wie seine Struktur war unbekannt, bis jetzt.
Ein Bericht von der Si-Labor und Mitarbeiter, online veröffentlicht März 13, 2020, in der Wissenschaftgeprägt hat, auf atomarer-Ebene Auflösung, die Struktur von Orb2 gereinigt aus seiner nativen Quelle (die Gehirne von Millionen von Fruchtfliegen) und gezeigt, dass es in der Tat existieren als funktionale amyloid im Gehirn. Diese Studie, geführt von Ruben Hervas, Ph. D., ist zum ersten mal eine amyloid-eine bekannte biologische Funktion hat, die jemals gereinigt wurden und strukturell beschrieben aus dem Gehirn. Interessant ist, die amyloid – (self-assembled) Falten von Orb2 fördert die Produktion von Speicher-Verwandte Proteine, während die Monomere (single protein) Falten von Orb2, hemmt die Produktion von Speicher-Verwandte Proteine, die angibt, die ein protein einnehmen kann mehrere Funktionen durch die Annahme mehrerer Formen.



